全球导致婴儿住院的第一大“致命杀手”RSV病毒:迎来审判时刻
“一到冬天,十个娃九个咳。”这句话常常在家长口中流传。
除了常见的普通感冒和流感,还有一种更危险的呼吸道病毒,传播能力比流感更强,严重的可致命,也是全球导致婴儿住院的第一大原因——它就是呼吸道合胞病毒(RSV)。
1月17日,mRNA药物研发龙头莫德纳(Moderna)公布,其开发的呼吸道融合病毒(RSV)疫苗mRNA-1345,在临床III期试验中“至少能够预防咳嗽、发烧或呼吸困难等两种症状”,针对65岁以上成年人、与RSV相关的下呼吸道疾病(LRTD)防护力达到83.7%。
莫德纳预计可在今年上半年向美国食品药物管理局(FDA)提交批准申请。
当地时间1月30日,FDA授予Moderna的RSV候选疫苗“突破性疗法”称号。
突破性治疗药物的认定需满足两个条件:一是适应证为严重的或危及生命的疾病;二是有证据显示在某一重要临床终点上明显优于现有药物。
对绝大多数青年人而言,RSV通常会引起轻微的、类似感冒的症状,但对婴幼儿和老年人而言,则成了一种可以致命的疾病,每年导致1.4万名65岁以上的患者死亡。从去年秋天开始,RSV疾病在美国及欧洲肆虐。
假设它将很快获得批准,那么首批RSV疫苗可能会产生什么影响?
幼儿和老人“致命杀手”
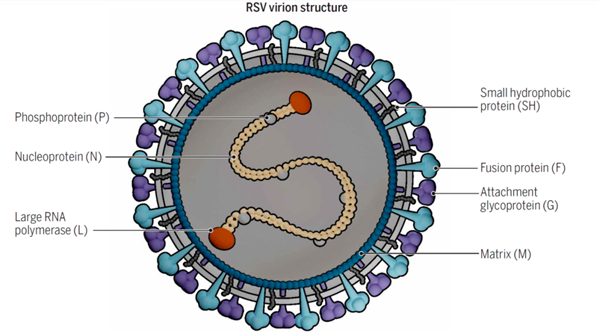
1956年,科学家从黑猩猩呼吸道标本分离出RSV病毒,因其在细胞培养过程中导致相邻细胞融合,细胞病变形成类似合胞体的结构而被称为呼吸道合胞病毒。
RVS的基因组结构为非节段性单股负链RNA,基因组全长约为15.2kb,编码11个蛋白质。
由于RSV早期感染症状容易和感冒混淆,其危害性长期以来没有得到真正的重视。严重RSV感染大多侵犯身体机能更弱、免疫系统不完善的人群,比如孩子和老人。而对于婴幼儿来说,RSV就像藏在呼吸系统中的“致命杀手”,是全球婴儿住院的首要致病因素。
但目前尚未有针对RSV病毒的特效药物,只能事先使用单克隆抗体来进行预防,且必须每个月注射一次。
知名学术期刊Science的最新调查结果显示,美国地区最近几个月病例激增,给医疗保健系统带来不小的压力。在一个月到一岁左右的婴儿中,RSV是全球第二大死因,仅次于疟疾。
成年人的数据则相对较少:2022年的一项研究估计,美国每年约有6,500人死于RSV,其中65岁以上人群的死亡率最高。
在新冠疫情爆发前,冬季是呼吸道病毒流行的季节,但新冠疫情期间的防疫政策降低了新冠病毒和RSV病毒的传播。
从下图可见,新冠疫情前,2018年末至2020年初,美国的RSV相关住院率,由每年10月开始攀升,到翌年1月高峰期后开始回落,但在2020年初,新冠疫情爆发以来,各种控制疫情的措施,如居家隔离、戴口罩等,降低不同病毒的传播,令2020年10月至2022年初,美国的RSV相关住院率并未如往年在秋冬季激增。
但随着防疫政策放宽,在美国踏入秋冬时,RSV病毒出现甚至比新冠疫情爆发前更高的住院率。
回到国内,我国被认为是全球因RSV感染导致儿童下呼吸道感染(LRTI)人数最多的国家之一。据WHO统计,2020年全球约有3,500万5岁以下儿童感染RSV,其中我国儿童患者有300万人。
一项研究显示,国内5岁以下儿童因RSV引起的急性下呼吸道感染住院人数占全球总数的18~27%;平均来看,我国每天有2,500名幼儿因RSV感染住院,一年有高达7,400名幼儿因此死亡。
但是针对每个年龄段开发的产品带来了不同的机遇和挑战。“RSV 疫苗领域不是一个领域,而是两个,”荷兰乌得勒支大学医学中心专攻传染病的儿科医生Louis Bont说,“一个是保护婴儿,一个是保护老人。”
对RSV疫苗的探索始于1960年代,经历了无数次失败后,直到2013年,科学家在破译病毒用于锚定和进入人体细胞的蛋白质结构方面取得的突破,为当前的RSV疫苗研究铺平了道路。
即便如此,目前仍未有任何一款针对成年及老年人的RSV病毒疫苗获得批准上市,包括辉瑞以及葛兰素史克等大型药厂都在竞相研发相关产品。辉瑞以及葛兰素史克已在去年年底,向美国食品药物管理局提交老年人RSV疫苗的药证申请,其中,辉瑞的疫苗防护力为66.7%。
另外,赛诺菲(Sanofi)以及阿斯利康(AstraZeneca)开发的婴儿RSV疫苗已获得欧盟委员会的上市许可,目前正在接受FDA的审查。
突破性疗法,“突破”在哪里?
有时候我们会用“打败仗”来形容身体被病菌入侵而病倒了,可幸的是身体会在这次败仗中获得免疫力。即是说,痊愈后的身体并不会再被同一种病菌入侵。
接种疫苗,就如为身体的免疫系统做了一次军事演习,让它记住针对某病菌(抗原)的防御 ,并刺激抗体产生,从而获得免疫力。以后若真的有病菌试图入侵身体时,免疫系统就可以迅速作出反应,将病菌击退。
由于mRNA是人体内蛋白质合成路径中的核心介质工具,这让其可以行使疫苗的功能。
mRNA疫苗的作用原理与传统疫苗一样,都是激发我们身体免疫力。传统疫苗是直接把已削弱毒性、已“死”的病毒躯壳,或其表面抗原送入身体,来刺激免疫系统制造抗体。而mRNA疫苗则是含有新毒表面抗原的mRNA遗传指令,先需靠人体细胞内的蛋白质合成机制,执行mRNA的指令去产生抗原,然后才触发身体的免疫反应
相比于传统灭活病毒疫苗,mRNA疫苗并未携带所有能制造新冠病毒的核酸(nucleic acid),不会进入人体细胞核、也不会改变DNA或与之发生作用;所以施打疫苗,并不会让人感染病毒,安全性较高。
此外,mRNA在细胞内快速降解的特性,也能让mRNA在产生蛋白质后快速代谢。而mRNA疫苗最强大的优势,是制程快速,只需完整的遗传密码,就能制出疫苗,因此能在瞬息万变的疫情中占尽先机。
Moderna的相关管线,就是基于mRNA这一工具,让该病毒表达的蛋白质稳定在体内生成,以此刺激免疫系统,生成相应的抗体。而辉瑞和葛兰素史克疫苗直接注射相关蛋白,试验中它们的功效十分相似。
但Moderma认为,自己的mRNA疫苗所提供的初始保护,以及免疫力持久性会更优。莫德纳旗下的RSV疫苗mRNA—1345组成包含编码稳定预融合(prefusion)F醣蛋白的单股RNA,并使用与新冠疫苗相同脂质纳米颗粒(lipid nanoparticles,LNP)包裹。
mRNA—1345的第III期临床试验招募来自22国、约3.7万名超过60岁的成年受试者,其临床有效指标(primary efficacyendpoints)在于预防 RSV的下呼吸道相关疾病的两个以上或三个以上症状,前者达83.7%的有效性,后者则达82.4%的有效性。
根据莫德纳的新闻稿指出,该疫苗的耐受性皆良好,目前也无安全疑虑。常见的负面反应包含部位疼痛、疲倦、头疼、肌肉痛与关节痛等,全身性严重不良反应(3级或更高)的整体发生率为4.0%,局部不良反应的整体发生率为3.2%;而安慰剂组的全身性不良反应与局部不良反应的整体发生率则分别为2.8%与1.7%。
但mRNA疫苗也并非没有缺点,包括稳定性较差,递送门槛较高等。
目前国内也有药企将RSV疫苗推进到临床研发后期,例如生物制药公司优锐医药,于11月14日宣布其MVA-BN RSV疫苗III期临床IND申请获批,并将在2023年启动III期临床试验。
即便如此,谈到婴儿疫苗时,Moderna对外声称——“它是我们正在探索的产品之一。”
“我认为十年后,我们将开始研发针对妈妈们的RSV疫苗。”辉瑞公司疫苗临床研发副总裁Alejandra Gurtman解释说,在怀孕期间接种疫苗会产生高水平的母体抗体,这些抗体会通过胎盘转移到胎儿体内,从而在婴儿出生后的头几个月保护他们。
辉瑞公司去年11月报告的试验表明,在怀孕期间接种疫苗的孕妇所生婴儿被RSV感染的可能性大大降低。而Moderna表示它正计划进行类似的试验,但出于安全考虑,葛兰素史克去年停止了妊娠试验。
针对儿童RSV预防不仅仅停留在为孕妇接种疫苗,另一种方法是为新生儿预防性注射RSV蛋白抗体:一种由阿斯利康和赛诺菲开发的抗体已于2022年11月获准广泛使用。
当然,在疫苗正式获批上市之前,对于绝大多数普通人而言,加强防护始终是重点。
本站所有文章、数据、图片均来自互联网,一切版权均归源网站或源作者所有。
如果侵犯了你的权益请来信告知我们删除。邮箱:business@qudong.com